COVID-19是由一种新型冠状病毒2(SARS-CoV-2)所引起的急性严重呼吸系统综合症,于2019年出现,截至2021年6月1日,全球已感染超过1.7亿人[1]。常见的初始症状和体征包括咳嗽、发烧、疲劳、头痛、肌肉酸痛和腹泻[2]。症状通常在感染后约1周内开始出现,一些COVID-19患者病情严重,呼吸困难是发展为严重病况最常见的症状之一,通常也伴有低氧血症;严重的COVID-19感染通常导致患者之呼吸衰竭(respiratory failure),也可能导致危及生命的肺炎(pneumonia)、多器官衰竭,甚至死亡[3]。
COVID-19防治方法为何?
有效的COVID-19疫苗对于预防进一步的发病率和死亡率至关重要,针对COVID-19的疫苗可能会对抗感染、疾病或传播,对于患者产生重症情况和死亡有保护作用,进而有助于疾病控制[4]。目前,多个国家已经投入疫苗的研发,而当前的每种疫苗研发策略都有明显的优点和缺点[5]。尤其,必须针对高危险人群进行疫苗接种,包括第一线医护人员、60岁以上的个人以及患有慢性疾病(尤其糖尿病和高血压等)的人[6]。
目前有哪些COVID-19疫苗?
冠状病毒(coronavirus)是一种球形病毒(RNA病毒),颗粒大小约为100nm,目前来说有3个亚群、16种以上的冠状病毒被发现[7]。 SARS-CoV-2基因组的三分之二显示复制酶(replicase)的表达,三分之一为蛋白酶(proteinase)的表达,其可利用自身合成之复制酶及蛋白酶合成出四种结构蛋白是棘蛋白(spike protein, S)、封套蛋白(envelope protein , E)、膜蛋白(membrane glycoprotein, M)和核壳蛋白(nucleocapsid protein, N);由于新型冠状病毒的不断进化使其具有在人群中快速传播的能力[8]。
许多研究都显示,针对棘蛋白(spike protein, S)来设计疫苗是最好的目标,因为S蛋白负责将病毒附着在宿主细胞表面受体(最有可能在第二型血管收缩素转换酶,Angiotensin converting enzyme-2, ACE2)上,因此针对SARS-CoV-2的S蛋白的抗体可以干扰病毒,进而达到中和病毒引起的感染[9]。因此许多COVID-19疫苗开发平台都针对S蛋白去做设计及研发[8]。
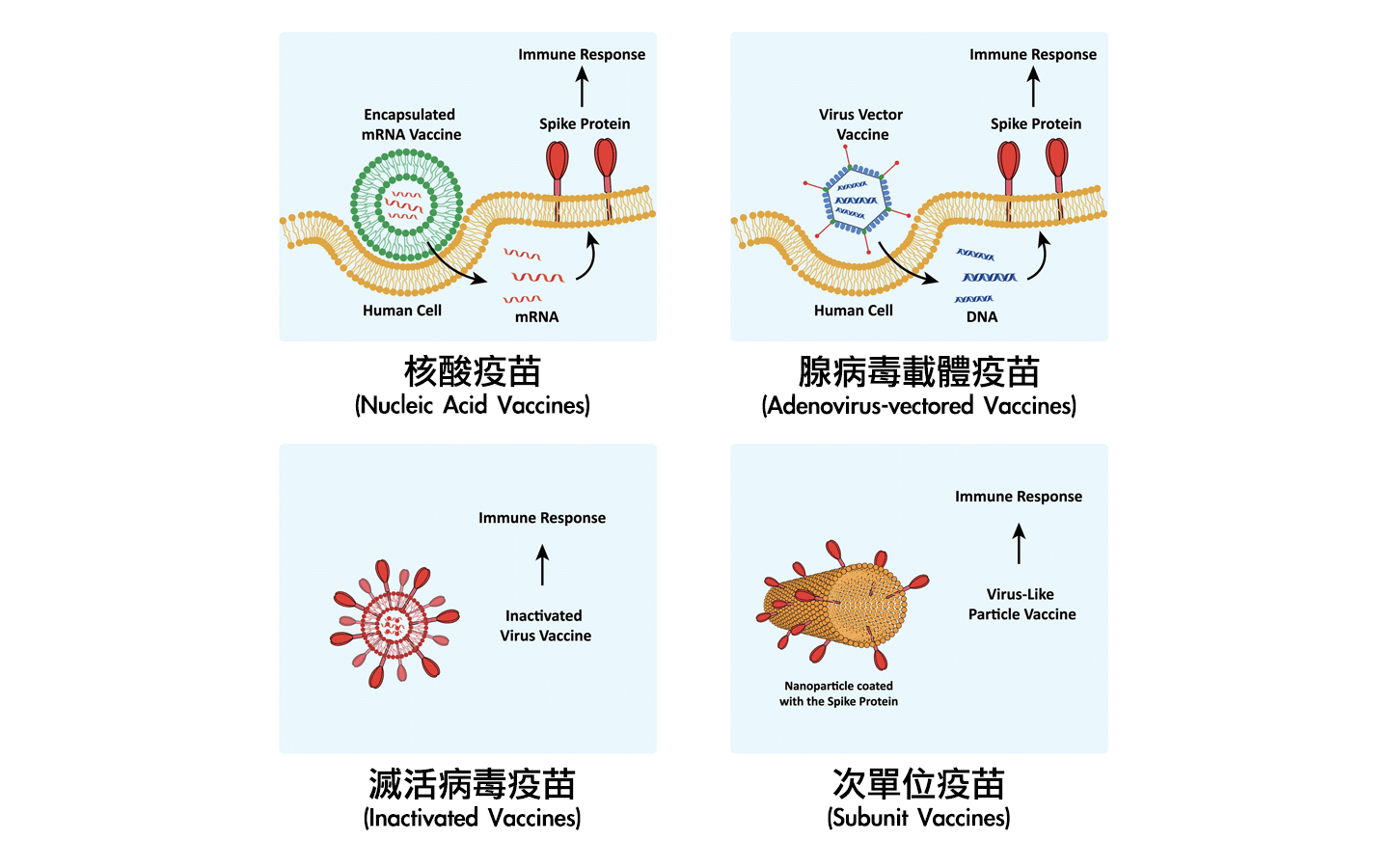
目前主要的COVID-19疫苗种类有许多种,常见的为:灭活病毒疫苗(Inactivated Vaccines)、腺病毒载体疫苗(Adenovirus-vectored Vaccines)、次单位疫苗(Subunit Vaccines)、核酸疫苗(Nucleic Acid Vaccines)[5]。
各COVID-19疫苗的差异?
-
灭活病毒疫苗(Inactivated Vaccines)
减活性或是非活性之全病毒疫苗是一般常见的病毒疫苗研发策略。基本上是使用不同的技术来减弱病毒的活性,但由于是将活的病毒注射进人体,它们主要诱导针对病毒表面之第二型血管收缩素转换酶(Angiotensin converting enzyme-2, ACE2)蛋白的保护性抗体,此类病毒疫苗通常需要大量的额外测试来确认其安全性。
此外,由于是使用活的或灭活的全病毒之新冠状病毒疫苗,已经有发生在进行免疫接种后有传染性增加的情况,这对于新冠状病毒疫苗来说是一个严重的问题[5] [8]。此类型的疫苗,主要是由武汉生物制品研究所和国药控股开发的灭活的SARS-CoV-2病毒全疫苗[10]。
-
腺病毒载体疫苗(Adenovirus-vectored Vaccines)
此类型的疫苗原理,是将能制造新型冠状病毒主要抗原,棘蛋白(spike protein)的基因,利用基因重组技术将此基因插入载体(Vector)中,此载体无法被复制,但是可以进入直接人体细胞内,借此利用细胞自身制造出棘蛋白,透过制造出的棘蛋白来刺激人体的免疫力。
最常用的病毒载体是腺病毒(Adenovirus)载体,主要优势是能够同时诱导体液免疫和细胞免疫[8]。此类型的疫苗有美国娇生(Ad26.CoV2.S)公司研发制造,使用黑猩猩(chimpanzee)腺病毒做为载体;以及英国牛津大学与美国阿斯特捷利康(ChAdOx1 nCov-19)合作研发制造,使用第26型人类腺病毒做为载体[10]。
-
次单位疫苗(Subunit Vaccines)
使用来自不同病原体的高度纯化的重组蛋白是疫苗研究中最常见的研发技术[8]。 SARS冠状病毒的次单位疫苗的基础是建立在引发针对S-spike蛋白的免疫反应,以防止其与宿主之第二型血管收缩素转换酶(Angiotensin converting enzyme-2, ACE2)受体结合,此类型疫苗是由SARS-CoV的S-spike蛋白受体结合域(receptor-binding domain, RBD)所组成,一样利用基因重组技术,将可以制造出抗原之棘蛋白的基因插入细胞的DNA之中,再透过大量培养经过基因重组的细胞后,进一步纯化培养出来的棘蛋白,即是次单位蛋白疫苗。
此外,此类型疫苗会诱导中和抗体,而不会引起 Th2 型免疫病理学,RBD类型疫苗的一个优势是它能够最大限度地减少宿主免疫增强作用[5] [11]。此类型的疫苗有美国Novavax(NVX-CoV2373)及台湾高端(MVC-COV1901)、台湾联亚(UB-612)等公司研发制造[10]。
-
核酸疫苗(Nucleic Acid Vaccines)
几家主要的生物技术公司都拥有先进COVID-19核酸疫苗平台。例如,Inovio Pharmaceuticals正在开发DNA疫苗,而Moderna Therapeutics(美国莫德纳)和Curevac等其他公司则选择RNA疫苗平台[5]。一般来说,RNA的疫苗比DNA的疫苗具有多种优势,可直接将mRNA直接注射到宿主细胞中,在细胞质(cytoplasm)中进行转译(Translation)。
这种疫苗已经成功在许多不同的抗原疫苗中进行检测,并且已经证明在多种物种中是有效的,包括小鼠、非人类灵长类动物和人类[12]。此类型的疫苗有美国莫德纳(mRNA-1273)及美国辉瑞与德国BioNTech(BNT-162b2)合作制造等[10]。
各COVID-19疫苗的副作用比较
这边以台湾有进货或是国际上常见的COVID-19疫苗来做个直接的比较[13] [14]。
| 辉瑞/BNT | AZ | 莫德纳 | 娇生 | 高端 | |
| 疫苗类型 | mRNA | 腺病毒载体 | mRNA | 腺病毒载体 | 次单位蛋白 |
| 接种剂量 | 0.3 mL | 0.5 mL | 0.5 mL | 0.5 mL | (待公布) |
| 接种途径 | 肌肉注射 | 肌肉注射 | 肌肉注射 | 肌肉注射 | 肌肉注射 |
| 接种年龄 | 16岁以上 | 18岁以上 | 18岁以上 | 18岁以上 | 20岁以上 |
| 接种剂次 | 2剂 | 2剂 | 2剂 | 1剂 | 2剂 |
| 两剂保护力 | 95% | 81% | 94% | 67% | (待公布) |
| 施打间隔 | 4周 | 10-12周 | 4周 | – | 4周 |
| 常见副作用 | 头痛、疲倦、泛红、接种部位胀痛、恶心、畏寒 | 头痛、发烧、倦怠、肌痛、关节痛、恶心、接种部位胀痛、呕吐、血小板低下症、发冷、腹泻、红斑 | 头痛、发烧、疲倦、肌痛、关节痛、恶心、接种部位胀痛、呕吐、淋巴结肿大、寻麻疹、接种部位红斑畏寒 | 注射处疼痛、发烧、瘙痒,肿胀、瘀青 | 注射处疼痛、红斑、肿胀、肌肉酸痛、疲劳、发烧、腹泻 |
| 少见副作用 | 心肌炎、淋巴结肿大、脸部单侧麻痹 | 血栓、头晕、嗜睡、多汗、搔痒、皮疹、淋巴结肿大 | 心肌炎、接种部位搔痒、脸部肿胀、颜面神经麻痹 | 罕见凝血障碍、血栓 |
总结
COVID-19疫苗种类相当多种,每一个疫苗施打都会有过敏反应的风险,因此民众可以依个人意愿和身体状况与医师讨论后,选择比较适合自己的身体状况施打的疫苗,同时在施打疫苗后30分钟以及28天之内观察自己身体的变化,如有不适的身体反应请尽速至邻近医院就诊,同时让医师知道您施打过COVID-19疫苗。目前全球COVID-19疫情持续延烧,打疫苗还是对抗新冠肺炎的全球趋势,当然做好个人卫生勤洗手戴口罩也是非常重要的。



